|
Gramnegative oropharyngeale Bakterien als Verursacher von Endocarditis.
Die orale Plaque mit weit über 300 verschiedenen Bakterienspezies bildet komplexe Biozönosen auf Hart- und Weichgeweben der Mundhöhle. Besonders subgingival in den Zahnfleischtaschen entstehen organisierte Aggregate von anaeroben und aeroben Mikroorganismen, welche sich durch Matrixbildung und Stoffwechselinteraktionen gegen äußere Einflüsse wie Lysozyme, Antikörper aber auch antimikrobielle Medikamente schützen. Innerhalb dieser Biofilme finden unterschiedliche Keime der dentalen Flora und Bakterien des oberen Respirationstrakts ideale Bedingungen für Wachstum und Vermehrung. Durch die so provozierte Entzündungsreaktion kommt es im Rahmen von Gingivitis und Parodontitis zur Zerstörung der epithelialen Schranke, zum Eindringen von Keimen in tiefere Gewebsschichten und oft bereits bei geringen Manipulationen, wie mechanischer Zahnreinigung, zur Einschwemmung in die Blutgefäße.
Dies führt zunächst lediglich zu passageren Bakteriämien, welche bei gesundem Organismus nach kurzer Zeit von selbst abklingen. Allerdings bei Patienten mit primärer oder sekundärer Abwehrschwäche und/oder vorgeschädigtem Herzen besteht erhöhtes Risiko zur Entwicklung einer bakteriellen Endocarditis. Dazu gehören Patienten mit Zustand nach vorangegangener Endocardentzündung, mit Klappenvitien, mechanischem oder biologischem Klappenersatz, Klappenrekonstruktionen mittels alloprothetischem Material; weiters Patienten mit angeborenen Herzfehlern, wie zyanotischen Läsionen ohne systemisch-pulmonaler Shuntoperation, aber auch operierte Herzfehler mit Conduits oder residualen Defekten. Prinzipiell stellen alle Eingriffe am Herzen, welche unter Verwendung von prothetischem Material durchgeführt werden, in den ersten sechs Monaten nach der Intervention ein Risiko zur Entwicklung einer infektiösen Endocarditis dar.
Für solche Risikopatienten gibt es Richtlinien der WHO zur antimikrobiellen Endocarditisprophylaxe bei entsprechenden zahnärztlichen Eingriffen. Diese umfassen alle mechanischen Eingriffe wie Scaling, Wurzelglättung und parodontalchirurgische Interventionen, welche zu erleichtertem Eindringen von Krankheitserregern in den Blutkreislauf führen können.
„Kulturnegative Endocarditis“ durch langsam wachsende Bakterien
Bakterielle Endocarditis entsteht durch Absiedelung von Bakterien auf der Innenschichte des Herzens und an den Klappen. Die Keime bilden Vegetationen, welche dann durch den Blutstrom verschleppt werden und sekundär zu Gefäßverschlüssen in Form septischer Embolien und zu Infarktgeschehen in den betroffenen Organen wie Apoplex im Gehirn, Lungenembolie und Nierenversagen führen.
Eine Gruppe besonders problematischer Erreger sind die Keime der sogenannten HACEK-Gruppe, welche Auslöser der „kulturnegativen“ Endocarditiden sind. Die Bezeichnung ist irreführend: Es handelt sich vielmehr um Bakterienspezies, welche nur sehr langsam auf den Nährböden anwachsen, wodurch sich ihre Identifizierung und die Bestimmung der Antibiotikaempfindlichkeit sehr zeitaufwändig gestaltet. Mittels spezieller PCR-Kits kann die Dedektion der Erreger heute deutlich rascher durchgeführt werden. Die Bezeichnung HACEK steht für die Anfangsbuchstaben folgender Bakterienarten: Haemophilus parainfluenzae, Aggregatibacter (ehemals Actinobacillus) actinomycetem comitans, Cardiobacterium hominis, Eikenella corrodens und Kingella kingae. Sie sind für immerhin 5–10% aller bakteriellen Endocarditen verantwortlich. Sämtliche beteiligten Spezies sind gramnegative Stäbchen, welche zur menschlichen Mund- und Rachenflora gehören. Zumindest Aggregatibacter und Eikenella stehen in engem Zusammenhang mit parodontalen Erkrankungen, die anderen drei Spezies besiedeln bevorzugt den Rachenraum, können aber im Zuge gingivaler Läsionen auch in die Sulkusflora integriert werden und damit auch bei Läsionen vermehrt ins Blut gelangen.
Aggregatibacter bildet spezifische Adhäsine zur Besiedelung von Endocard
Besondere Bedeutung kommt dem mit aggressiver Parodontitis vergesellschafteten A. a. comitans zu. Dieses gramnegative, fakultativ anaerobe Stäbchenbakterium steht in Zusammenhang mit der lokalisierten juvenilen Parodontitis, spielt jedoch auch bei parodontalen Läsionen Erwachsener eine wichtige Rolle. Der Keim verfügt über potente Pathomechanismen, die zu Gewebsinvasion und raschem Gewebsverlust führen. Eine besondere Gefahr für den Gesamtorganismus ergibt sich aus seiner Fähigkeit zur Besiedelung nativer und prothetischer Herzklappen sowie auch von atheromatösen Plaques. In einer Studie aus Japan konnte A. a. comitans in 31% der untersuchten Endocarditisfälle und auch in aortalen Aneurysmen mittels molekularbiologischer Methoden nachgewiesen werden. In den meisten Fällen waren Patienten mit vorgeschädigten Herzklappen oder Klappenersatz betroffen. Bei der Besiedelung der cardialen Strukturen spielen Adhäsine eine wichtige Rolle. Dies sind einerseits bakterielle Fimbrien, welche den Konnex zum Wirtsgewebe ermöglichen, andererseits auch epitheliale Adhäsine, welche die Anheftung an Epithelien ermöglichen. Das für die Endocardbesiedelung wichtige extrazelluläre Matrixprotein EmaA bildet Strukturen aus, welche die Interaktion zu den wichtigsten Kollagentypen (Kollagen I, II, V) des Bindegewebes ermöglichen, welche einerseits im Parodontium, andererseits auch in den Gefäßen und Herzklappen enthalten sind. Bei Patienten mit Arteriosklerose und Hypertension kommt es außerdem zu einer vermehrten Akkumulation extrazellulärer Matrix in der Adventitia, welche vermehrt die entsprechenden säurelöslichen Kollagene enthält (Gaoyan Tang et al., 2008).
Eikenella corrodens assozierte Endocarditis betrifft vor allem die Tricuspidalklappe
Der zweite für die „kulturnegative Endocarditis“ relevante orale Keim ist Eikenella corrodens, ein mikroaerophiles, kokkoides gramnegatives Stäbchenbakterium, welches auf Nährmedien ein korrodierendes Wachstumsmuster zeigt. Bei gingivalen und parodontalen Erkrankungen gehört das Bakterium zur mäßig pathogenen Begleitflora, kann aber regelmäßig im Sulkus nachgewiesen werden. Bei eikenellaverursachter Endocarditis bilden sich große, gestielte Vegetationen auf der Tricuspidaklappe. In zahlreichen Studien ist der Zusammenhang mit vorangegangenen dentalen Eingriffen wie Zahnextraktionen belegt. Neben Endocarditis kann der Keim auch Osteomyelitis, kutane und subkutane Abszesse sowie Infektionen des Urogenitaltrakts verursachen. Eikenella reagiert sensibel auf Ciprofloxacin, Ceftriaxon, Cefotaxim, Amikacin und Chloramphenicol, ist aber resistent gegen Clindamycin, Metronidazol und Penicillin. Da gerade diese Antibiotika im zahnmedizinischen Bereich häufig bei parodontalen Entzündungen eingesetzt werden, ist bei gefährdeten Patientengruppen eine mikrobiologische Abklärung hinsichtlich Eikenella zu empfehlen.
Die weiteren Vertreter der HACEK-Gruppe besiedeln primär den oberen Respirationstrakt
Cardiobacterium hominis, Kingella kingae und Haemophilus parainfluenzae sind gramnegative Stäbchenbakterien, welche den Hals-/Rachenraum vor allem bei Kindern und Jugendlichen besiedeln. Obwohl primär keine parodontal-pathogenen Organismen, besteht auch bei der durch diese Spezies verursachten Endocarditis ein enger Zusammenhang mit invasiven zahnärztlichen Interventionen. Betroffen sind auch hier cardial vorgeschädigte oder gefährdete Patienten. Cardiobacterium hominis hat nur niedrige Virulenz, sodass es bei Infektionen eher zu einer subakuten Endocarditis kommt. Oft bestehen unspezifische Symptome wie Müdigkeit, Abgeschlagenheit, Myalgien, Arthralgien und Gewichtsverlust über Perioden bis zu 11 Monaten. Cardiobacterium reagiert sensibel auf Cephalosporine der dritten Generation wie Ceftriaxon.
Kingella kingae ist ein sehr seltener Endocarditiserreger, kann jedoch bei Kindern auch zu septischer Arthritis und Meningitis führen.
Im zahnärztlichen Bereich sollte bei cardial und/oder immunologisch gefährdeten Patienten eine mikrobiologische Abklärung hinsichtlich der HACEK-Gruppe erfolgen. Bei Erregerpositivität sind hier Cephalosporine der dritten Generation das Mittel der Wahl.
DDr. Christa Eder
FA für Pathologie und Mikrobiologin
eder.gasometer@chello.at
|
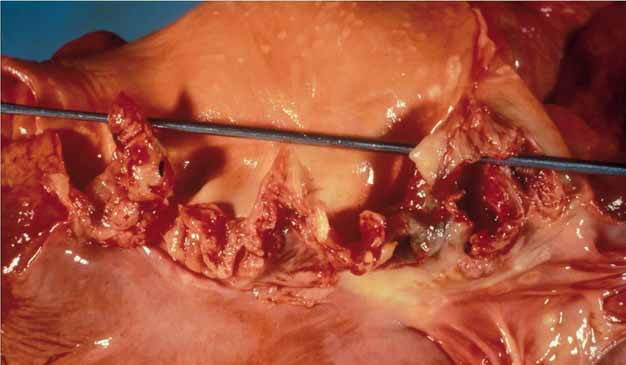
Akute Endocarditis
|



