|
Das Mikrobiom der Mundhöhle entwickelt sich im Laufe des Lebens in Abhängigkeit von exo- und endogenen Einflüssen zu einem komplexen Kleinökosystem. Interaktionen zwischen den Wirtsgeweben und den Mikroorganismen entscheiden nicht nur über Gesundheit oder Krankheit der oralen Strukturen, sondern haben auch erhebliche systemische Auswirkungen.
Entzündliche Läsionen wie Parodontitis, Gingivitis und Stomatitis verursachen eine Störung der Barrierefunktion der Schleimhautepithelien und begünstigen so die Einschwemmung pathogener Keime in die Blutbahn. Wir wissen heute, dass Krankheitsbilder wie Parodontitis mit einer Verschiebung der Anteile der mikrobiellen Spezies in Richtung gramnegativer, anaerober oder fakultativ anaerober Bakterien einhergeht. Keime wie Porphyromonas gingivalis, Prevotella intermedia, Aggregatibacter actinomycetemcomitans und Treponema denticola zählen zu den sogenannten Leitkeimen und sind wichtige Parameter zur Diagnose einer floriden Entzündung des Zahnhalteapparates.
Subgingivale Biofilme – Nischen für atypischer Erreger
Darüber hinaus schaffen diese Keime ein geeignetes Milieu für die Ansiedelung primär nicht oraler, aber aggressiver Mikroorganismen. Die zunächst von den klassischen Parodontitisbakterien verursachte Dysbiose führt nicht nur zu einer passageren Besiedelung der Zahnfleischtaschen durch „mundfremde“ Mikroorganismen, sondern ermöglicht diesen auch, sich in den subgingivalen Biofilmen zu etablieren und dort das
Krankheitsgeschehen voranzutreiben. Besondere Konditionen, wie immunologische Probleme, welche häufig bei Patienten mit Diabetes oder systemischen Grunderkrankungen auftreten, begünstigen Wachstum und Vermehrung dieser Keime. Die meisten nicht-oralen Pathogene sind gramnegative, opportunistische Keime, welche nicht selten multiple Resistenzen gegen Antibiotika aufweisen und deshalb zu den MRGNs (multiresistente Gramnegative) gezählt werden. Ihre Anwesenheit in der supra- und subgingivalen Plaque führt über Superinfektionen zu aggressiven, oft therapierefraktären Krankheitsverläufen. Zu dieser Gruppe zählen Escherichia coli, Enterobacter cloacae, Enterobacter agglomerans, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeroginosa und Acinetobacter baumannii. Diese nicht-oralen Keime besetzen eine für sie eigentlich nicht vorgesehene ökologische Nische. Die keimbeladenen Biofilmteilchen aus den Zahnfleischtaschen werden im Rahmen des Entzündungsgeschehens durch bakteriämische Aussaat zu fast sämtlichen Organen unseres Körpers transportiert oder über Aspiration von Speichel in die tiefen Atemwege eingebracht. Bei geschwächter Immunabwehr können gefährliche und sogar lebensbedrohende Infektionen
wie Bronchopneumonie, Meningitis und Endokarditis bis hin zur Septikämie mit Multiorganversagen ausgelöst werden.
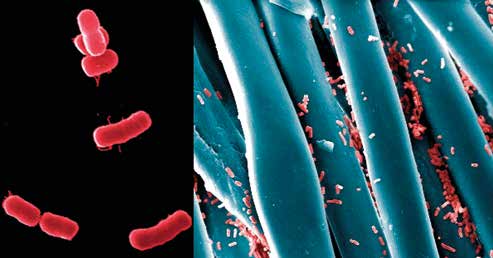
Systemische Erkrankungen durch multiresistente Acinetobacter
Acinetobacter baumannii ist wegen seiner häufigen multiplen Antibiotikaresistenzen in den Ruf eines „superbugs“ gekommen. Er verfügt über bis zu 52 Antibiotikaresistenzgene. Mittels Effluxpumpen kann er antimikrobielle Substanzen aus seinen Zellen entfernen und damit unwirksam machen. Acinetobacter ist ein gefürchteter Erreger nosokomialer Infektionen, der als „Escape-Organismus“ auf gängige Therapien nicht anspricht und sich auch als äußerst widerstandsfähig gegenüber Desinfektionsmitteln erweist. Wie auch einige Keime aus der Gruppe der Enterobakterien kann er ein erweitertes Enzymspektrum an Betalaktamasen bilden und damit resistent gegen Penicilline und Cephalosporine werden. Nicht selten bildet er auch Carbapenemasen, was ihn zusätzlich unangreifbar für diese Reserveantibiotika macht. Im Krankenhausbereich werden Keime mit derartigen Fähigkeiten vereinfachend in 3 und 4 MRGN unterteilt. Dies bezieht sich auf die Anzahl der Resistenzen gegen die häufig eingesetzten Antibiotikaklassen Acylureidopenicilline, Cephalosporine der 3. und 4. Generation, Fluorchinolone und Carbapeneme. In einigen, besonders dramatischen Fällen wurde sogar eine Panresistenz gegenüber sämtlichen derzeit in Gebrauch befindlichen
antibiotischen Substanzen nachgewiesen.
Bakterielle Interaktion fördert Resistenzbildung
Die Fähigkeit von Acinetobacter zur Biofilmbildung und Integration in polymikrobielle Gemeinschaften ermöglicht ihm Überleben und Vermehrung an unterschiedlichsten Lokalisationen, wie eben auch in der dentalen Plaque. Keime der frühen Residentflora, wie S. sanguis, können eine dauerhafte Besiedelung mit Acinetobacter durch Absonderung spezifischer bakterizider Komponenten in einer ausgewogenen gesunden Mundflora zunächst verhindern. In einer gestörten oralen Biozönose mit überproportionalem Anteil an Anaerobiern kann sich A. baumannii aber ideal im Biofilm etablieren. Besonders die Carbapenemase produzierenden Formen assoziieren sich nicht nur mit den klassischen Parodontalkeimen, sondern auch mit weiteren nicht-oralen Erregern wie Enterobakterien und Klebsiellen. Acinetobacter sezerniert „Outer Membrane Vesicles“, über die er Resistenzgene an andere Spezies weitergibt. Zudem verfügt er über eine Reihe potenter Pathomechanismen, welche ihn sowohl für die Hart- und Weichgewebe der Mundhöhle als auch für die Atemwege besonders gefährlich macht. Seine permanente Anwesenheit in der Sulkusflora steht nachweislich in Zusammenhang mit aggressiver Parodontitis, Eiterungen und Wurzelkanalinfektionen. Die Zahnfleischtaschen bilden ein permanentes Reservoir und somit ein geschütztes Biotop für Acinetobacter. Eine Sanierung florider Taschen ist daher nicht nur eine Frage der Mundgesundheit, sondern schützt vor allem Patienten mit immunschwächenden Grunderkrankungen vor schwerwiegenden Konsequenzen.
DDr. CHRISTA EDER
FA für Pathologie und Mikrobiologin
eder.gasometer@chello.at
|